[미세먼지의 과학] 미세먼지와 초미세먼지가 뭔지 설명 없이 다짜고짜 위험하다고 해서 답답하다면 여깁니다.
초미세먼지의 2차 생성 메커니즘(화학식)까지 총정리해 드립니다!
일상생활 속 주제를 과학적으로 설명합니다. 자신의 진로희망에 맞춰 과학탐구/과학실험 주제를 만들어 심화학습, 생기부 세특, 수행평가, 동아리, 진로활동, IB 물리·화학·생물 IA나 EE 등에 활용해 보세요 :)
목차

1. 미세먼지란?
미세먼지(particulate matter)는 단순히 크기가 매우 작은 먼지가 아니라, 여러 화학적 유해물질이 혼합된 에어로졸(aerosol)입니다. 자연적인 발생보다 인위적인 발생이 대부분을 차지하며 주로 난방, 가정의 주방, 자동차 연료, 사업장(공장), 발전소 연소 등에서 나오는 분진으로 이뤄져 있습니다.
| 에어로졸(연무질, aerosol) 공기 중에 있는 고체나 액체 상태의 입자상 물질 전부 |
▲ 미세먼지의 크기 측정: 미세먼지 vs. 초미세먼지
알다시피 미세먼지는 직경에 따라 10μm 이하인 미세먼지(PM10)와 2.5μm 이하인 초미세먼지(fine particulate matter, PM2.5)로 나뉩니다. 그런데 미세먼지의 크기와 모양은 불규칙하죠. 공과 같이 둥근 물체는 그 지름을 쉽게 측정할 수 있으나, 미세먼지는 크기와 모양이 다양하기 때문에 미세먼지(PM10)과 초미세먼지(PM2.5)를 구분하기 위해서는 '먼지의 크기'를 정의하는 기준이 필요합니다.

우리가 사용하는 미세먼지 간이측정기는 미세먼지의 크기를 측정하기 위해 미세먼지의 광학적 특성을 활용하여 빛을 쬐서 산란하는 현상을 측정합니다. 이때 빛이 산란된 정도를, 구 모양의 표준입자가 빛을 산란시키는 정도와 비교하면 상대적인 직경을 구할 수 있습니다.
반면, 한국환경공단의 대기환경 실시간 정보시스템인 '에어코리아'에서는 미세먼지의 공기역학적 특성을 활용합니다. 미세먼지는 중력과 저항을 받으면서 아래로 침강하는데, 미세먼지와 동일한 침강속도를 가진 구 모양의 표준입자를 매칭하여 상대적인 직경을 파악합니다. 이렇게 측정된 미세먼지는 지름에 따라 미세먼지와 초미세먼지로 분류되고, 각각의 농도가 측정되어 미세먼지 예보로 우리한테 전달됩니다.
▲ 미세먼지의 생성 과정: 미세먼지에 대한 오해
미세먼지가 생성되는 과정은 지구가 자기정화하는 과정의 일부입니다. 항상 나쁘다고만 생각했던 미세먼지라 당혹스럽죠?
구체적으로 미세먼지의 구성 성분들 각각이 어떻게 생성되는지를 살펴보기 앞서, 미세먼지에 대해 거시적인 이해를 도모해 봅시다.
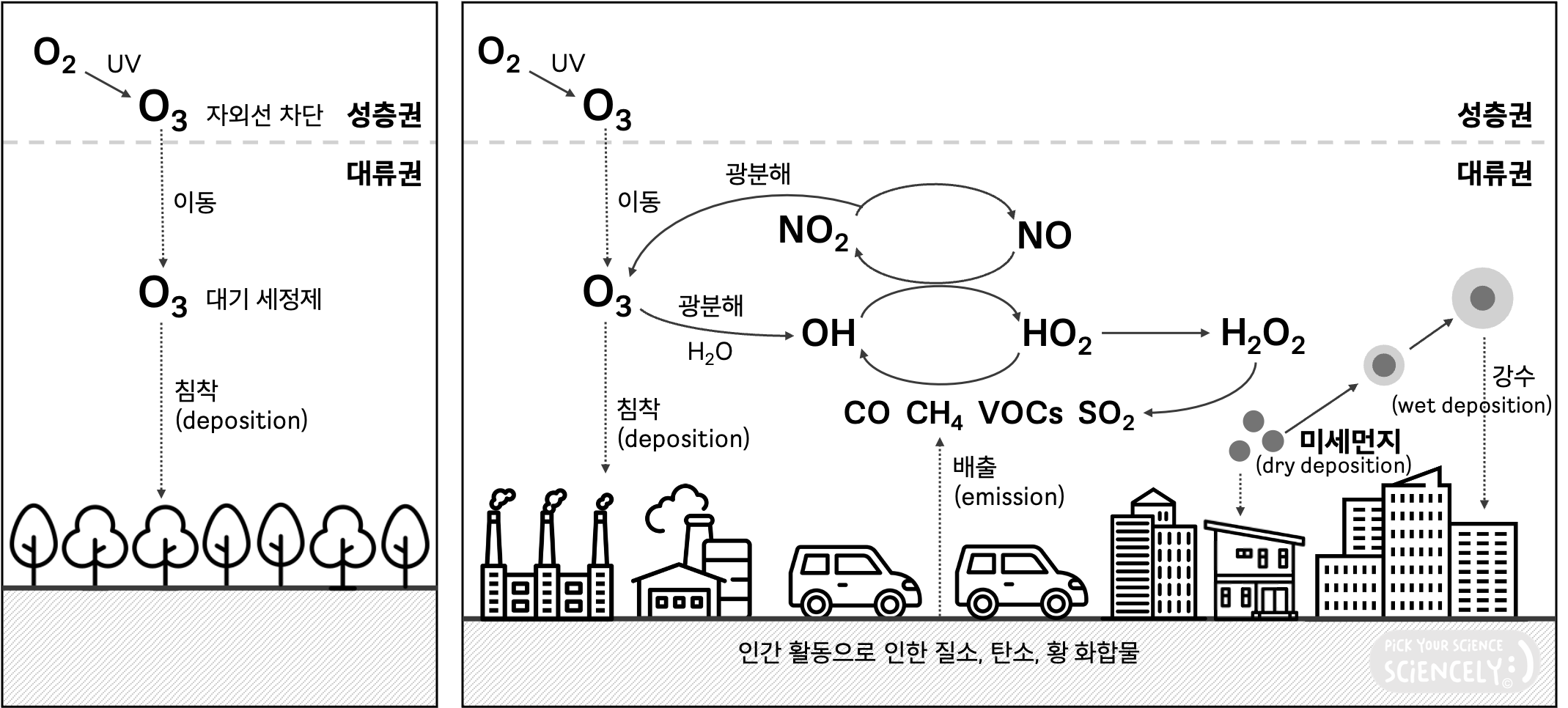
좌측 그림은 배경대기(background atmosphere) - 즉, 산업 발전 이전의 청정한 대기를 가정하고 있습니다. 여기선 성층권에서 대기 중 오존(O₃)의 대부분이 형성되는데, 오존은 햇빛의 자외선에 의한 광화학 반응으로 생성되어 오존층을 이루고 자외선을 차단하며 지구의 생명체를 보호합니다. 일부의 오존은 대류권으로 이동하는데, 그중 일부는 대기를 깨끗이 하는 세정제(detergent)의 역할을 수행하고, 나머지 일부는 지표면으로 침착(deposition)됩니다. ➡ 이렇게 지구는 자체적으로 필요한 만큼의 오존을 유지했습니다.
우측 그림은 도시대기(urban atmosphere) - 즉, 오늘날 우리가 생활하는 대기를 가정하고 있습니다. 성층권에서 오존이 생성되고, 대류권으로 내려와 대기를 세정하고 침착되는 것까지 동일합니다. 그러나 인간 활동으로 인해 질소, 탄소, 황 화합물들이 대기로 배출(emission)되고, 오존과의 여러 복잡한 화학반응들로 인하여 대류권에는 이제 잉여의 오존과 오염물질들이 생겨납니다. 지구는 자정(자기정화)의 경향성을 지니기 때문에, 이러한 오염물질들을 제거하기 위해 산화과정을 일으킵니다. 여기서 발생한 결과물이 미세먼지이고, 미세먼지가 직접 지표면으로 가라앉기도 하며(dry deposition) 또 강수를 유발하여 산성비를 통해 대기 중의 나쁜 물질들을 지표면으로 침착(wet deposition)시킵니다.
아직 그림 속에 등장한 화학물질들을 몰라 완전히 이해하기 어려울 수 있습니다. 여기서 중요한 건 미세먼지가 생기는 배경에는 지구 자정이 있다는 것이며, 단지 과하게 많은 미세먼지가 지표로 내려와 사람한테 해를 가한다는 겁니다!
| 오존과 하이드록실 라디칼 - 지구를 정화하는 '세정제' 대류권에서 오존은 광화학 반응을 통해 대기를 정화시키는 세정제의 역할을 수행합니다. 정확히는 이 반응에서 생성된 하이드록실 라디칼(hydroxyl radical, HO·, ·OH, OH)이 "대기의 세정제(detergent of the atmosphere)"라고 불리는데, 그 반응 과정에 대해 살펴보겠습니다. ① 성층권에서 산소분자(O₂)가 햇빛의 자외선(UV)을 흡수하며 광분해(photochemical breakdown, photolysis)가 일어나 2개의 들뜬 산소원자(O*)를 만듭니다. 그리고 이 들뜬 산소원자(O*)가 주변 산소분자(O₂)와 결합하여 오존(O₃)을 형성합니다.  ② 오존(O₃)은 또 자외선(UV)으로 광분해되어 산소분자(O₂)와 들뜬 산소원자(O*)로 나뉩니다. 이 들뜬 산소원자(O*)가 주변 물(H₂O) 분자와 결합하여 2개의 하이드록실 라디칼(OH)을 형성합니다.  하이드록실 라디칼(HO·, ·OH, OH·, OH)은 수산화물 이온의 중성 형태로, 매우 높은 반응성 때문에 빠르게 다른 화합물로부터 전자를 뺏어오는(공유하는) 강한 산화제이기도 합니다. 이러한 특징으로 하이드록실 라디칼은 대기 중 유기화합물인 탄화수소(hydrocarbon, CxHx) 분자나 질소산화물 등의 오염물질과 산화반응을 하며 "대기를 세정"합니다.  ※ NASA 또한 홈페이지에 "Detergent-like Molecule Recycles Itself in Atmosphere"란 기사를 게재함 |
2. 초미세먼지란?
크기가 작아 더욱 위험한 초미세먼지(PM2.5, fine particulate matter, fine aerosol)는 대부분 특정 배출원에서 직접 생성되는 1차 오염물질이 아닌, 대기 중 기체상태의 전구물질(전구체, precursor)이 반응인자나 중간생성물과 만나 화학반응을 거치거나 햇빛이 광화학 반응을 일으켜 만들어진 2차 오염물질입니다. 여기서 전구물질은 '미세먼지 전구물질'로, 대기 중에서 화학적 반응을 거쳐 미세먼지를 생성하는 반응물질(reactant)을 의미합니다.
| 광화학 반응(photochemical reaction) 물질이 빛을 흡수하고 그 빛에너지(E = hν, ν는 빛의 진동수로 파장에 반비례)로 인해 일어나는 모든 화학적 반응 |
▲ 초미세먼지의 구성 성분
초미세먼지(PM2.5)는 ▲탄소화합물(유기탄소, 원소탄소), ▲무기성 이온(황산염, 질산염, 암모늄), ▲금속화합물 등으로 구성됩니다. 지역에 따라 초미세먼지 화학성분 조성 중 어느 것이 더 높은 성분 비율을 차지하는지 달라지는데, 자동차가 많은 서울시나 공장이 많은 울산시는 이온성분이, 산림지역이 많고 농축산업이 집중된 강원도는 탄소성분이 높습니다.

3. 초미세먼지: 무기성 이온(이온성분)
이온성분의 초미세먼지는 대기 중에 떠다니는 기체상태의 아황산가스(SO₂), 질소산화물(NOx), 암모니아(NH₃) 등의 전구물질과 반응인자나 중간생성물 간의 화학반응 또는 광화학 반응으로 생성됩니다. 즉, '2차 미세먼지'입니다. 여기에는 대표적으로 황산염(sulfate, SO₄²¯), 질산염(nitrate, NO₃¯), 암모늄(ammonium, NH₄⁺)이 있는데, 이 셋을 묶어서 “SNA(sulfate, nitrate, ammonium)”라 칭합니다.

구체적으로 각 전구물질이 어떻게 초미세먼지에 이르는지는 복합적인 과정이라 간단한 몇 줄의 화학반응식으로 정리하기 어렵습니다만 간략히 그 발생원인과 형성 과정에 대해 살펴보겠습니다.
▲ 발생 원인
황산염(sulfate, SO₄²¯)의 전구물질인 아황산가스(SO₂)를 비롯한 황산화물(SOx, sulfur oxides)은 주로 화력발전소, 금속제련공장, 난방시설(예: 아파트, 상업용 건물) 등에서 석탄, 석유와 같은 화석연료가 연소될 때 발생합니다. (입장에 따라 황산화물을 통틀어 초미세먼지의 주범으로 보기도 합니다.) 아황산가스는 상태에 따라 이산화황로도 부르는데, 황이 연소될 때 발생하며 자극적인 냄새가 나는 무색의 기체이며, 산성비의 전구물질이기도 합니다.
질산염(nitrate, NO₃¯)의 전구물질인 질소산화물(NOx)은 주로 자동차 배기가스, 발전소에서의 화석연료 연소 등에서 비롯됩니다. 질소산화물 중 주요한 형태는 일산화질소(NO)와 이산화질소(NO₂)이기 때문에 질소산화물을 "NOx"로 표기하는데, 이외 밤 시간대의 질산 생성에 기여하는 오산화이질소(N₂O5)도 주목해야 합니다.
암모늄(ammonium, NH₄⁺)의 전구물질인 암모니아(NH₃)는 인간과 가축이 배출하는 분뇨, 질소비료를 사용하는 농업과 그 생산 공장, 하수 및 쓰레기 처리시설 등이 주요 배출원입니다. 암모니아는 자극성 있는 향과 강한 부식성으로 특징되는 무색의 알칼리성 기체이나, 그 자체로는 소량일 경우 인체에 큰 위협이 되지 않습니다. 그러나 대기 중 암모니아는 빠르게 암모늄으로 전환되는데, 황산염, 질산염 같은 음이온과 반응하여 2차 오염물질인 황산암모늄(ammonium sulfate, (NH₄)₂SO₄)과 질산암모늄(ammonium nitrate, NH₄NO₃)을 생성합니다.
▲ 형성 메커니즘
90년대에 이르러 오존이 만들어지는 과정에 대한 상세 연구가 진행됐는데, 안타깝게 아직도 정확히 황산염/황산, 질산염/질산, 그리고 다른 유기산(organic acids)들이 어떻게 만들어지는지에 대해 밝혀지지 않았습니다. 물론 이론을 바탕으로 세우는 산화 과정식은 간단하지만, 실제로 관찰된 현상들을 설명해내지 못하고 있는 게 실정입니다. 지금까지 이론적으로 파악된, 대기 중 이산화황과 질소산화물의 산화 과정에 대해 알아보겠습니다.

대기 중 이산화황은 ①기체(gas) 상태일 때 하이드록실 라디칼(OH)에 의해 산화되어 황산(H₂SO₄)을 생성하고, ② 수용액(aqueous) 상태일 때 과산화수소(H₂O₂), 오존(O₃)과 반응하여 황산염(SO₄²¯)을 생성합니다 (Hardacre et al., 2021; Shostak et al., 2019).
| 산화(oxidation) 원자, 분자 또는 이온이 산소(O)를 얻거나 수소(H) 또는 전자(e¯)를 '잃는' 반응 |

① 아황산가스(SO₂)는 하이드록실 라디칼(OH)과 반응하여 삼산화황(SO₃)을 생성하고, SO₃는 다시 대기 속 물방울에 의해 가수분해 되어 황산(H₂SO₄)을 생성합니다. ② 대기 속 물방울에 용해된 이산화황(SO₂)은 물(H₂O)과 반응하여 아황산수소이온(sulfite ion, HSO₃¯)을 형성하고, 이는 다시 과산화수소(H₂O₂)나 오존(O₃)과 반응하여 황산염(SO₄²¯)을 생성합니다.
| 대기 중 하이드로퍼옥실 라디칼과 과산화수소(HOx radical cycle in atmosphere) 하이드로퍼옥실 라디칼(hydroperoxyl radical, HO₂, HO₂·, HOO·)은 양성자화된 초과산화물(superoxide, O₂¯)로, 대기화학에서 주로 일산화탄소(CO)나 탄화수소의 산화 부산물로 만들어져 오존을 파과하는 등 다양한 대기 반응에 참여합니다.  과산화수소(hydrogen peroxide, H₂O₂)는 강력한 산화제로 OH와 마찬가지로 주변 오염물질을 산화분해하여 미세먼지를 생성시켜 대기를 정화합니다. 과산화수소는 일산화탄소나 휘발성유기화합물(VOCs)이 광화학 반응하여 생성한 하이드로퍼옥실 라디칼이 결합하며 생성되기 때문에, 대기 화학에선 OH-HO₂-H₂O₂의 형성 과정을 하나의 사이클로 봅니다. |
이산화황(SO₂)보다 질소산화물(NOx)이 산화되어 질산염이나 질산을 생성하는 과정이 훨씬 복잡(물질들이 빠르게 생성과 소멸을 반복)하여 뒤늦게 연구가 시작됐습니다. 대기 중 질산염이 만들어지는 과정은 낮과 밤 시간대에 따라 달라지는데, 이는 하이드록실 라디칼(OH) 농도와 관련 있습니다.

위에서 하이드록실 라디칼(OH)은 광화학 반응(자외선 흡수로 인한 광분해)을 통해 만들어진다는 걸 확인했는데, 낮과 달리 밤에는 태양광이 없어 대기 중 OH 농도가 급격히 떨어집니다. 낮 시간대에 이산화질소(NO₂)는 OH에 의해 산화되어 질산(HNO₃)을 형성하는데, 밤에는 OH가 없어 오존(O₃)으로 인한 반응으로 대체됩니다. 위 그림에 대해 차근히 살펴보겠습니다.
청정한 대기배경에서 일산화질소(NO), 이산화질소(NO₂), 그리고 오존(O₃)은 생성과 소모가 균형된 상태로 순환(balanced, null cycle)합니다. 그러나 인간 활동으로 인해 NO를 포함한 오염물질들이 배출되고, 이제 O₃ 외에도 다른 물질들이 NO를 산화시킵니다. 이 결과로 대기 중 NO₂가 증가하고 잉여의 O₃가 형성됩니다.
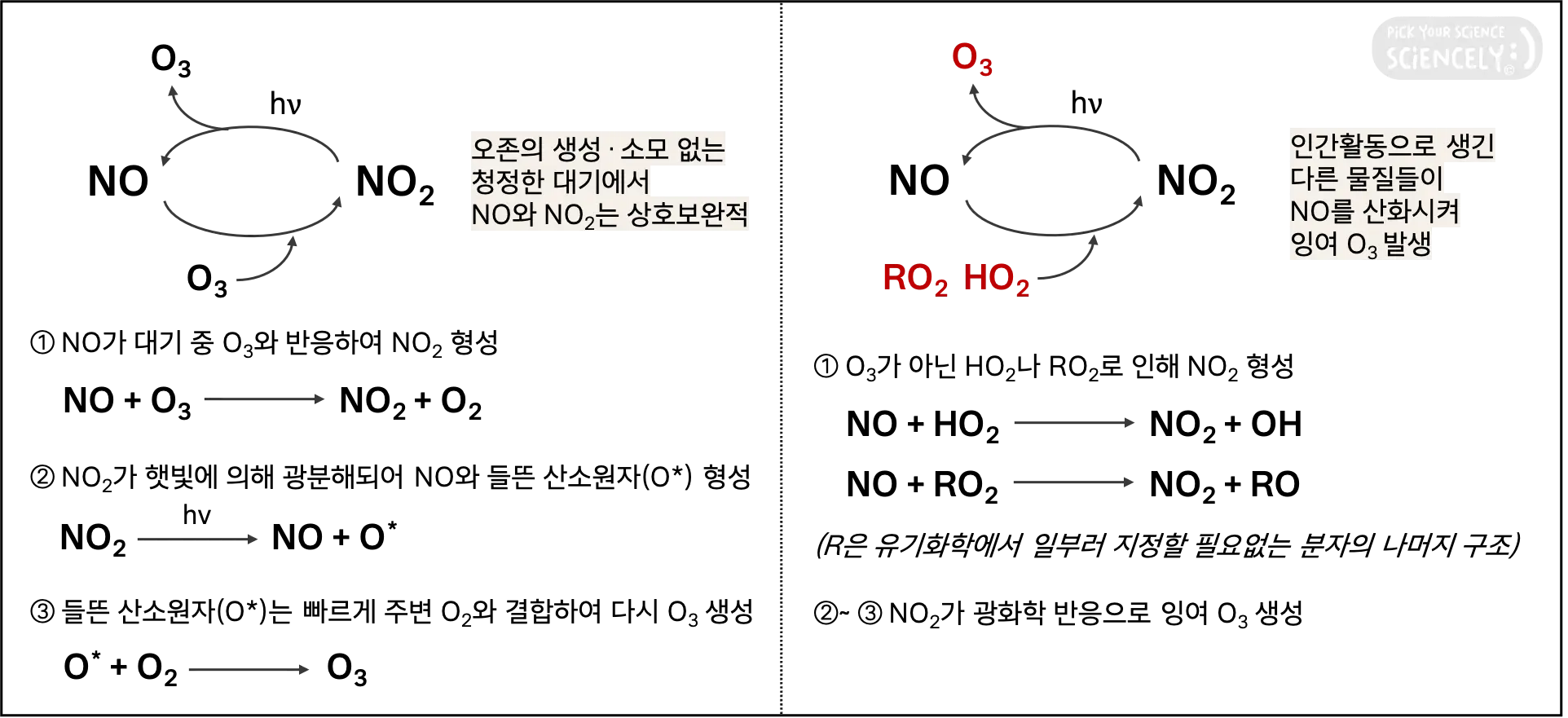
대기 중 오존(O₃)이 과다한 건 그 자체로도 온실가스라 안 좋지만, 다른 1차 오염물질과 반응하여 2차 오염물질인 초미세먼지 생성에 기여해서 문제됩니다. 많아진 NO₂는 낮 시간대에 하이드록실 라디칼(OH)과 반응하여 초미세먼지인 질산(HNO₃)을 만들고, 밤 시간대에 잉여 O₃와 반응하면 초미세먼지인 질산염 라디칼(NO₃)을, 그리고 다시 NO₃과 결합하면 오산화이질소(N₂O5)를 거쳐 질산염(NO₃¯)을 생성합니다.

이외에도 이산화질소(NO₂)는 다양한 물질과 반응하여 2차 오염물질을 만드는데, 위 그림처럼 대표적으로 아질산(HONO), 유기성 질소(Org N), PAN(peroxyacetyl nitrate, 질산과산화아세틸) 등이 있습니다. 담배나 가공육에도 있는 아질산(HONO)이나 PAN이 지닌 인체 유해성은 익히 들어봤을 텐데, 모두 심각한 발암성 독성물질이자 대기오염물질입니다.
암모니아에 대해서는 비교적 간단히 살펴보겠습니다. 대기에 배출된 암모니아(NH₃)는 물방울에 용해되어 알칼리성 물방울을 형성하고, 이 물방울은 분해반응으로 암모늄(NH₄⁺)을 생성합니다. 이렇게 만들어진 암모늄(NH₄⁺)은 황산염(SO₄²¯)과 이온결합하여 황산암모늄((NH₄)₂SO₄)을, 질산염(NO₃¯)과 이온결합하여 질산암모늄(NH₄NO₃)을 생성합니다.

이를 다르게 보면, 황산(H₂SO₄)과 질산(HNO₃)이 각각 암모니아와 반응하여 황산암모늄과 질산암모늄을 생성하는 겁니다.
사실 위 화학반응식들은 우리가 알고 있는 기체화학 등을 바탕으로 이론적으로 작성된 거라, 실제 대기 속 황산암모늄과 질산암모늄을 설명하지 못합니다. 이게 무슨 의미인지 질산과 암모니아의 반응을 예시로 설명하겠습니다.

대기 중 질산은 가장 측정이 어려운 기체 중 하나이며, 질산과 암모니아 둘 다 잘 녹는 성질인 용해도(solubility)가 높아 대기 중에 얼마나 있는지 정확하게 파악하기 어렵습니다. 그런데 고체 상태의 질산암모늄 또한 불안정하고 반응성이 높아, pH가 조금만 낮아져도 쉽게 질산으로 증발해 버립니다. 마찬가지로 측정의 어려움이 있겠죠. 그러므로 이론적으론 화학반응식을 세울 수 있으나, 실증(실험적 증거)이 뒷받침되지 못하여 우리가 아직 초미세먼지 질산암모늄의 생성 메커니즘을 완전히 이해했다고 보기 어렵습니다.
4. 초미세먼지: 탄소화합물(탄소성분)
지금까지 이온성분에 대해 살펴봤는데, 이온성분만큼이나 탄소성분은 비등하게 우리 상공의 미세먼지를 구성하고 있습니다.
미세먼지의 구성 성분을 무기와 유기물질로 나눴을 때 황산염, 질산염, 암모늄은 무기물질에 해당합니다. 미세먼지의 탄소화합물(탄소성분)이라 했을 때는 미세먼지의 유기물질(OA = organic aerosol, OC = organic matter)을 보는 건데, 여기서 유기 탄소를 가진 에어로졸을 탄소 에어로졸(carbonaceous aerosol)이라 부릅니다.
▲ 탄소 에어로졸의 분류
탄소 에어로졸은 다시 원소탄소(EC, elemental carbon)와 유기탄소(OC, organic carbon)로 구분됩니다. 탄소 에어로졸이라 해서 탄소만 있는 건 아니고, 탄소 외에도 수소, 산소, 질소 등이 함께 있습니다. 보통 대기 중 유기탄소가 차지하는 비율이 더 높으나, 지역에 따라 정확한 EC:OC의 비율은 상이합니다.
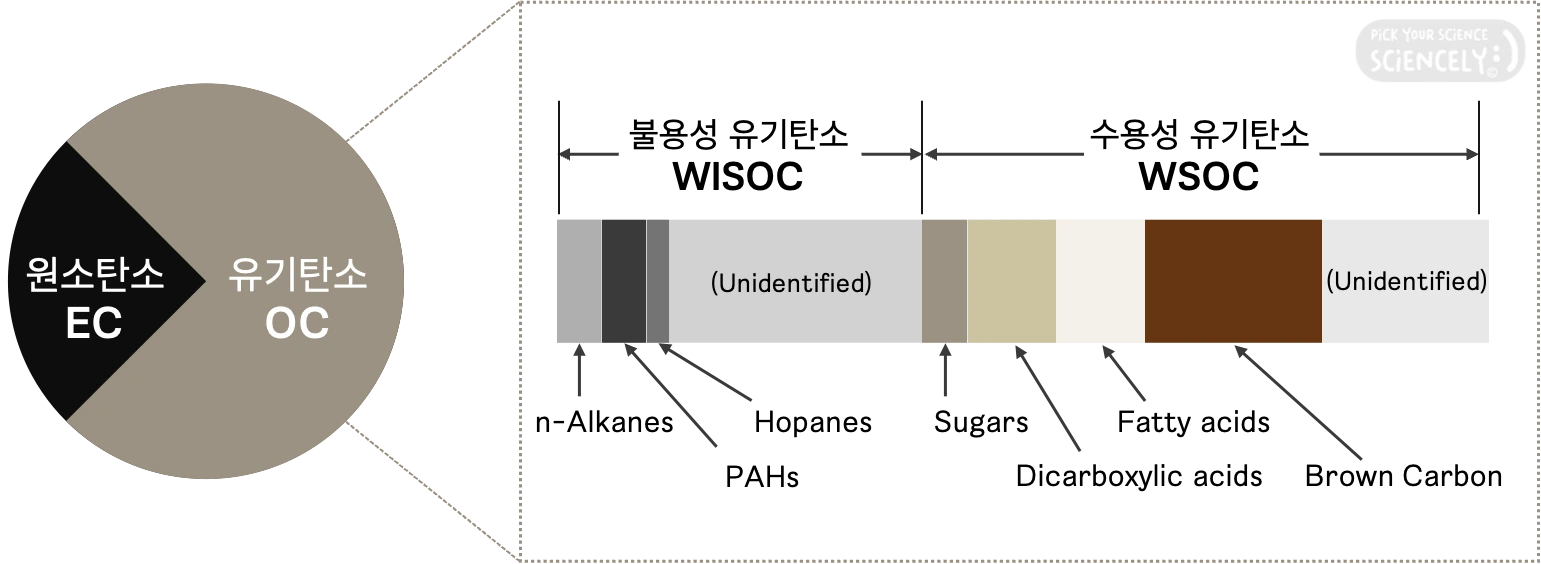
유기탄소(OC)는 물에 녹는지에 따라 세부 구분이 이뤄지는데, 불용성 유기탄소(WISOC, water insoluble OC)와 수용성 유기탄소(WSOC, water soluble OC)로 구분됩니다.
▲ 원소탄소(블랙카본)
원소탄소(EC)는 간단히 얘기하면 그을음으로, 대개 유기물의 불완전연소에 의해 생긴 미세한 검정색의 탄소함유물질입니다. 생김새 때문에 ‘블랙카본(black carbon, BC)’이라고 일컫기도 합니다. 원소탄소는 자동차 디젤엔진, 선박, 화력발전소, 바이오매스 연소(biomass burning) 등에서 탄화수소의 산화를 통한 불완전 연소로 발생하며, 발생원에서 직접 배출되는 1차 오염물질입니다.
원소탄소는 검은색이라 빛을 흡수하는 특징을 가지는데, 실제로 원소탄소는 대기입자가 흡수하는 빛의 90% 이상을 차지하며 온난화의 주범이기도 합니다.

| 바이오매스 연소(생체 소삭, 생물성 연소, biomass burning) 생활폐기물이나 농업잔재물의 노천 소각(예: 벼 수확 후 잔재물 소각), 목재 연료의 화목난로나 아궁이 사용, 산불 등에 의해 발생하며 휘발성유기화합물(VOCs), 일산화탄소(CO), 블랙카본 등 여러 온실가스의 발생 원인이기도 함 NASA에서는 90%의 바이오매스 연소가 인간 활동에 의해 발생한다고 예측하는데, 농업이 큰 비중을 차지하거나 화목으로 주거와 식생활 하는 국가에서는 바이오매스 연소로 인한 오염물질 배출이 심각함 |
▲ 유기탄소
유기탄소(OC)는 화석연료 연소, 사업장 배출, 바이오매스 연소의 직접 배출 외에도 대기 중 휘발성유기화합물(VOCs) 등이 광화학 반응을 일으켜 생성됩니다. 그렇기 때문에 유기탄소는 어떻게 생성됐는지에 따라 1차 유기분진은 POC(primary OC), 2차 유기분진은 SOC(secondary OC)로 분류됩니다.
| 휘발성유기화합물(volatile organic compounds, VOCs) 쉽게 증발하는 유기화합물로, 그 자체로 대기오염물질이자 대기 중에서 반응하는 미세먼지의 원인물질 중 하나 예) 파라핀(paraffin), 포름알데하이드(formaldehyde), 여러 방향족 화합물(aromatic compounds), 벤젠(benzene) |
유기탄소에 빛을 쬐면 주로 산란하기 때문에 광학적 특성으로 빛을 흡수하는 원소탄소(OC, 또는 BC)와 구분됩니다. 그러나 최근 연구를 통해 유기탄소 또한 일부 종류는 단파장의 빛을 흡수한다고 발견했는데, 유기탄소 중에서도 수용성 유기탄소(WSOC) 내의 Brown Carbon이 빛을 흡수합니다. Brown Carbon은 그 이름처럼 갈색을 띠고 있는데, 빛을 흡수한다는 것은 온난화에 영향을 미치는 것이기에 주목받고 있습니다.

초미세먼지의 성분을 분석할 때 유기탄소의 경우 유기 지표물질(organic marker compounds)로 어디서 비롯됐는지, 그 발생원을 파악합니다. 우리나라 상공에서 가장 빈번하게 검출된 유기탄소 그룹들은 다음과 같습니다.
- n-Alkanes (n-알케인, 노말 알케인): 고리 없이 단일 결합으로 수소와 탄소로만 구성된 물질
- PAHs (Polycyclic aromatic hydrocarbons, 다환방향족탄화수소): 2개 이상의 벤젠고리로 이뤄져 있는 발암물질이며, 예시로 옷장좀약의 나프탈렌이 있음 (+ "탄 음식 먹으면 암 걸린다"의 걔)
- Hopanes (호판): 농도가 높지 않으나, 자동차 윤활유 등에서 많이 발견됨
- n-Alkanoic acids (n-알케노익산): 단일 결합으로 수소와 탄소로 구성된 포화 지방산의 일종으로, 육류를 조리할 때 배출됨
- Sugars: 단당류(monosaccharide)의 일종으로, 생체 소각이나 식물의 뿌리로부터 비롯된 흙먼지에서 발견됨
- Dicarboxylic acids (다이카복실산): 두 개의 카복실산 작용기로 구성된 유기화합물로, 직접 배출도 되지만 VOCs가 계속 반응을 거치면서 생성됨
미세먼지와 황사의 차이
지금까지 초미세먼지의 상당 부분을 차지하는 이온성분과 탄소성분의 발생원인에 대해 살펴봤습니다. 처음에 미세먼지 발생원인은 대부분 인위적이나 자연적으로도 가능하다고 했는데, 자연적 발생원인에는 모래바람으로 인한 먼지, 산불로 인한 먼지, 화산재 등이 있습니다. 그리고 이러한 자연적 원인은 미세먼지와 황사 간의 구분을 모호하게 합니다. 그렇다면 황사는 미세먼지와 어떻게 다를까요?

우리나라 상공에 발생하는 황사는 중국, 몽골 사막지대에서 기류에 의해 실려온 토사(흙먼지)입니다. 미세먼지와 다르게 주요 성분은 토양 성분으로 칼륨, 철분, 알루미늄, 마그네슘 등이 포함되고, 크기가 통상적으로 1~10μm입니다. 오염되지 않은 황사 자체는 유해성이 미세먼지에 비해 상대적으로 낮으나, 황사 바람이 공기 중에 있는 다른 오염물질까지 실려 오기 때문에 생긴 2차 피해가 문제 될 수 있습니다.
5. 미세먼지의 위험과 예방
마지막으로 미세먼지가 우리 건강에 왜 해로운지와 예방 차원에서 미세먼지 예보를 읽는 법에 대해 알아보겠습니다.
세계보건기구(WHO)에서는 대기오염물질(air pollutants)을 미세먼지(PM10과 PM2.5), 오존(O₃), 이산화질소(NO₂), 일산화탄소(CO), 아황산가스(SO₂) 등으로 정의하고 있습니다.

미세먼지는 입자가 일반 먼지보다 작아 코점막, 구강, 기관지의 점액에 의해 걸러지지 않은 채 침투하여 호흡기 및 폐 질환(예: 천식)을 유발합니다. 특히 초미세먼지의 경우, 폐포를 통해 혈관까지 침투할 수 있어 순환계를 타고 몸 곳곳에 축적되고 또 심각하면 심혈관계 질환을 초래합니다. 세계보건기구는 미세먼지의 이러한 위험성을 인지하고 일찍이 2013년 10월에 이를 1군 발암물질로 분류했습니다.
▲ 미세먼지 예보 읽기
우리나라 환경부는 국민의 건강보호를 위해 매일 4번(5시, 11시, 17시, 23시)의 미세먼지 예보를 하고 있습니다.
미세먼지(PM10)와 초미세먼지(PM2.5)의 농도 범위에 따라 각 [좋음], [보통], [나쁨], [매우나쁨]의 4단계로 구분하고, 예보 등급은 미세먼지와 초미세먼지의 등급이 다를 경우 더 높은 등급을 기준으로 하고 있습니다. 예를 들어, 서울시의 미세먼지(PM10) 등급이 [보통]이고 초미세먼지(PM2.5) 등급이 [나쁨]이면 예보 등급은 [나쁨]입니다.

미세먼지는 예보 말고도 건강에 위해한 수준일 때를 위해 경보제를 실시하고 있습니다. 현재 환경부 기준, 미세먼지(PM10)의 시간당 농도가 150μg/m³ 이상이 2시간 이상 지속됐을 경우 주의보가 발령되고, 300μg/m³일 경우 경보가 발령됩니다. 한동안 미세먼지 재난문자 알림이 너무 자주 발송된다는 논란이 있기도 했는데, 미세먼지 재난문자 발송을 둘러싼 실효성 문제 또한 고민해 볼 필요가 있겠죠?
미세먼지가 나쁜 날에 마스크를 착용하여 우리의 몸을 보호할 수 있겠지만,
대기 중 미세먼지의 생성이 줄어들 수 있도록 원천적으로 차단하는 것이 이상적이겠죠?
1992년 채택된 유엔기후변화협약(UNFCCC), 1997년 채택된 교토 의정서(Kyoto Protocol)에 대해 한 번쯤은 들어봤을 겁니다.
이외에도 국제환경협약만 천 여개가 넘는다는데, 그럼에도 미세먼지의 전구물질인 여러 대기오염물질의 배출은 여러 국가와 산업 간의 이해관계가 얽힌 문제라 쉽게 해결되지 않고 있습니다.
유럽연합(EU), 미국 환경보호청(EPA)을 포함한 여러 기관에서 대기오염물질 배출허용기준을 강화하였고,
우리나라도 대기환경보전법으로 대기오염물질의 배출을 엄격히 관리하고 있습니다.
또한 수많은 과학자들이 미세먼지의 효과적인 저감을 위해 열심히 연구하고 있는데요,
여러분도 오늘 간략히 알아본 미세먼지(초미세먼지)를 구성하는 다양한 유해화학물질을 바탕으로
더불어 살아가는 건강한 지구촌을 위해 고민을 이어나가면 좋겠습니다!
참고자료
Akimoto, H., Tanimoto, H. (2020). Review of Comprehensive Measurements of Speciated NOy and its Chemistry: Need for Quantifying the Role of Heterogeneous Processes of HNO3 and HONO. Aerosol and Air Quality Research, 21. https://doi.org/10.4209/aaqr.2020.07.0395
Holt, J., Selin, N., Solomon, S. (2015). Changes in Inorganic Fine Particulate Matter Sensitivities to Precursors Due to Large-Scale US Emissions Reductions. Environmental Science & Technology, 49(8): 4834-4841. https://doi.org/10.1021/acs.est.5b00008
Jiang, Binfan & Xia, Dehong. (2021). Ammonia control represents the key for PM2.5 elimination: insights for global air pollution control interconnected from PM2.5 events in China. Clean Technologies and Environmental Policy, 23. 10.1007/s10098-020-01923-x.
Shostak, S., Kim, K., Horbatenko, Y., Choi, C. (2019). Sulfuric Acid Formation via H₂SO₃ Oxidation by H₂O₂ in the Atmosphere. The Journal of Physical Chemistry, 123: 8385-8390. https://doi.org/10.1021/acs.jpca.9b05444
Q. 미세먼지는 그냥 '작은 먼지'가 아니라고?
A. 미세먼지는 단순 크기가 작은 먼지가 아니라, 다양한 배출원에서 나온 1차 오염물질이 화학반응을 거쳐 생성된 2차 오염물질입니다. 미세먼지 구성성분은 무기성 이온, 탄소화합물, 금속 등 다양합니다.
Q. 미세먼지는 어떻게 우리의 건강을 위협하는가?
A. 특히 초미세먼지의 경우, 그 크기가 워낙 작아 폐포를 통해 혈관으로 침투해 순환계를 타고 몸 곳곳에 축적될 수 있습니다. 이는 폐와 호흡기 질환, 심장 질환 등을 유발합니다.
| 연관 전공 | 환경공학과, 화학과, 화학공학과, 화학생물공학과, 지구환경과학과, 산업보건학과, 바이오환경학과, 환경교육과, 지구과학교육과, 경영학과(ESG), 정책학과 |
| 관련 교과 |
「통합과학1」 2. 물질과 규칙, 3. 시스템과 상호작용 「통합과학2」 1. 변화와 다양성, 2. 환경과 에너지 「과학탐구실험2」 1. 생활 속의 과학 탐구 「화학」 3. 화학 평형 「화학 반응의 세계」 2. 산화·환원 반응, 3. 탄소 화합물과 반응 「지구과학」 1. 대기와 해양의 상호작용 |
이 포스팅이 재밌거나 도움이 되었다면 공감과 댓글 부탁드리겠습니다!
▼
'과학 이야기 > 실생활 속 과학' 카테고리의 다른 글
| 빵 속 글루텐 단백질, 면역학으로 보는 글루텐프리와 살 찌는 이유 (1) | 2025.01.22 |
|---|---|
| 미친 발광력의 아이돌 응원봉, LED 발광원리는 반도체?! (4) | 2025.01.21 |
| 물포자도 이해할 수 있는 전기자동차 회생제동, 멀미나는 이유 (4) | 2025.01.09 |
| 「흑백요리사」 리조또 100인분 웍질의 숨겨진 과학, 에멀젼과 만테까레 (6) | 2025.01.05 |
| 비싼 니트도 보풀이 생기는 이유, 울 섬유의 구조와 화학 결합 (4) | 2025.01.05 |
